♠ http://atomictheory3.blogspot.com/2011/05/modelo-atomico-de-sommerfeld.html
♠ http://quimica.laguia2000.com/general/modelo-atomico-de-schrodinger
♠ http://www.areaciencias.com/quimica/modelos-atomicos.html
♠ http://www.eis.uva.es/~qgintro/atom/tutorial-08.html
martes, 2 de junio de 2015
El modelo atómico de Schrödinger
El modelo atómico de Schrödinger no se trata de un modelo relativista, sino cuántico, que está basado en la ecuación que este físico austríaco realizó en 1925.
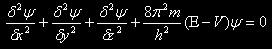
En conclusión, el modelo de Schrödinger, nos hace abandonar por completo
el concepto anterior de los electrones, que venían definidos como
pequeñísimas esferas cargadas que daban vueltas en torno al núcleo, para
dar paso a ver los electrones como una función de onda, y añadiéndonos
un útil concepto, el de orbital.
Modelo Atómico de Sommerfeld
En 1916, Arnold Sommerfeld, con la
ayuda de la relatividad de Albert Einstein, hizo las siguientes
modificaciones al modelo de Bohr:
- Los electrones se mueven alrededor del núcleo en órbitas circulares o elípticas.
- A partir del segundo nivel energético existen dos o más subniveles en el mismo nivel.
- El electrón es una corriente eléctrica minúscula.
En consecuencia el modelo atómico
de Sommerfeld es una generalización del modelo atómico de Bohr desde el
punto de vista relativista, aunque no pudo demostrar las formas de
emisión de las órbitas elípticas, solo descartó su forma circular.
Modelo Atómico de Bohr
El físico danés Niels Bohr ( Premio Nobel de Física 1922), propuso un nuevo modelo atómico que se basa en tres postulados:
Primer Postulado:
Los electrones giran alrededor del núcleo en órbitas estacionarias sin emitir energía
Segundo Postulado:
Los electrones solo pueden girar alrededor del núcleo en aquellas órbitas para las cuales el momento angular del electrón es un múltiplo entero de h/2p.
Tercer postulado:
Cuando un electrón pasa de una órbita externa a una más interna, la diferencia de energía entre ambas órbitas se emite en forma de radiación electromagnética.
Mientras el electrón se mueve en cualquiera de esas órbitas no radia energía, sólo lo hace cuando cambia de órbita. Si pasa de una órbita externa (de mayor energía) a otra más interna (de menor energía) emite energía, y la absorbe cuando pasa de una órbita interna a otra más externa. Por tanto, la energía absorbida o emitida será:

En resumen podemos decir que los electrones se disponen en diversas
órbitas circulares que determinan diferentes niveles de energía.

Primer Postulado:
Los electrones giran alrededor del núcleo en órbitas estacionarias sin emitir energía
Segundo Postulado:
Los electrones solo pueden girar alrededor del núcleo en aquellas órbitas para las cuales el momento angular del electrón es un múltiplo entero de h/2p.
Tercer postulado:
Cuando un electrón pasa de una órbita externa a una más interna, la diferencia de energía entre ambas órbitas se emite en forma de radiación electromagnética.
Mientras el electrón se mueve en cualquiera de esas órbitas no radia energía, sólo lo hace cuando cambia de órbita. Si pasa de una órbita externa (de mayor energía) a otra más interna (de menor energía) emite energía, y la absorbe cuando pasa de una órbita interna a otra más externa. Por tanto, la energía absorbida o emitida será:

Modelo Atómico De Rutherford
Modelo Atómico De Rutherford
Ernest Rutherford fue un químico y físico neozelandés que vivió entre los años 1871 y 1937 que dedicó gran parte de su vida a estudiar las partículas radioactivas (partículas alfa, beta y gamma) y fue el primero de todos en definir un modelo atómico en el que pudo demostrar que un átomo está compuesto de un núcleo y una corteza. Ganó el Premio Nobel De La Química en 1908.
Para Rutherford el átomo estaba compuesto de un núcleo atómico cargado positivamente y una corteza en los que los electrones (de carga negativa) giran a gran velocidad alrededor del núcleo donde estaba prácticamente toda la masa del átomo. Para Rutherford esa masa era muy muy pequeña. Esa masa la definía como una concentración de carga positiva.
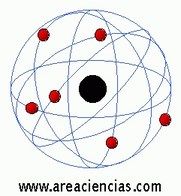
Ernest Rutherford fue un químico y físico neozelandés que vivió entre los años 1871 y 1937 que dedicó gran parte de su vida a estudiar las partículas radioactivas (partículas alfa, beta y gamma) y fue el primero de todos en definir un modelo atómico en el que pudo demostrar que un átomo está compuesto de un núcleo y una corteza. Ganó el Premio Nobel De La Química en 1908.
Para Rutherford el átomo estaba compuesto de un núcleo atómico cargado positivamente y una corteza en los que los electrones (de carga negativa) giran a gran velocidad alrededor del núcleo donde estaba prácticamente toda la masa del átomo. Para Rutherford esa masa era muy muy pequeña. Esa masa la definía como una concentración de carga positiva.

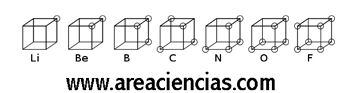
Modelo Atómico Cúbico De Lewis
Gilbert Newton Lewis fue un físico y químico estadounidense que vivió entre los años 1875 y 1946 que realizó numerosos trabajos científicos de los cuáles se destacan la “Estructura De Lewis” también conocida como el “Diagrama De Punto”. Está basado en un cubo, donde decía que los electrones de un átomo se colocaban de forma cúbica.
Gracias a ésta teoría se conoció el concepto de “valencia de un electrón” es decir, esos electrones en el último nivel de energía de un elemento que pueden reaccionar o enlazarse con otro elemento.
Veamos una imagen del Modelo Atómico Cúbico De Lewis:
Modelo atómico de Dalton y Thomson

John Dalton fue un químico y matemático británico (entre otras muchas cosas) que vivió durante los años 1766 y 1844, de donde procede la palabra “Daltonismo”.
Basándose en la idea de Demócrito, Dalton concluyó que el átomo era algo parecido a una esfera pequeñísima, también indivisible e inmutable.
Dalton hizo los siguientes “postulados” (afirmaciones o supuestos):
1. La materia está compuesta por partículas diminutas, indivisibles e indestructibles llamadas átomos.
2. Los átomos de un mismo elemento son idénticos entre sí (es decir, con igual masa y propiedades).
3. Los átomos de diferentes elementos tienen masas y propiedades distintas.
4. Los átomos permanecen sin división, incluso cuando se combinan en reacciones químicas.
5. Los átomos, al combinarse para formar compuestos (lo que hoy llamamos moléculas) mantienen relaciones simples.
6. Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
7. Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos. Para Dalton un átomo era algo así como una pequeña esfera.
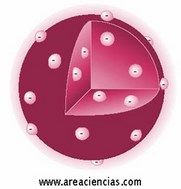
Modelo Atómico De Thomson
Joseph John Thomson fue un científico británico que vivió entre los años 1856 y 1940 que descubrió el electrón y los isótopos. Ganó el Premio Nobel de Física en 1906 y su teoría sobre el átomo decía que los átomos estaban compuestos por electrones de carga negativa en un átomo positivo, es decir, como si tuviéramos una bola cargada positivamente rellena de electrones (carga negativa), también conocido como Modelo del Pudin De Pasas porque parece un bizcocho relleno de pasas.
La electricidad fue lo que ayudó a Thomson a desarrollar su modelo. El error que cometió Thomson fue que hizo suposiciones incorrectas de cómo se distribuía la carga positiva en el interior del átomo.
Modelo atómico de Demócrito
Este fue el primer modelo atómico que se inventó por el filósofo griego
Demócrito de Abdera que vivió entre los años 460 al 370 a.c (antes de
Cristo).

Demócrito fue el desarrollador de la “Teoría Atómica Del Universo”. Demócrito fue el primer filósofo científico que afirmó que los átomos son eternos, inmutables e indivisibles, es decir, que duran siempre, que no cambian y que no pueden dividirse en partículas más pequeñas. Para Demócrito el átomo era la partícula más pequeña que había, una partícula homogénea, que no se puede comprimir y que además no se puede ver…
De hecho la palabra “átomo” proviene del griego “á-tómo” que significa “sin división”.

Demócrito fue el desarrollador de la “Teoría Atómica Del Universo”. Demócrito fue el primer filósofo científico que afirmó que los átomos son eternos, inmutables e indivisibles, es decir, que duran siempre, que no cambian y que no pueden dividirse en partículas más pequeñas. Para Demócrito el átomo era la partícula más pequeña que había, una partícula homogénea, que no se puede comprimir y que además no se puede ver…
De hecho la palabra “átomo” proviene del griego “á-tómo” que significa “sin división”.
Objetivo General
Crear un blog sobre las propuestas de los modelos de átomos a lo largo de la historia, mediante la aplicación de un gestor de blogs, para proporcionar de manera sencilla y adecuada información sobre este tema.
Suscribirse a:
Comentarios (Atom)